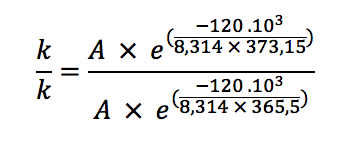Bonjour!
Je suis occupée à faire plusieurs exercices en chimie concernant la cinétique d'une part et les constantes ébullioscopiques d'autre part.
J'essaie en vain de faire cet exercice mais je n'y arrive pas...
Sous une pression de 1,00 atm, il faut trois minutes pour faire cuire un œuf à la coque. L’énergie d’activation de la réaction de cuisson de l’œuf dans l’eau bouillante (assimilable à la coagulation de l’albumine) est estimée à 120 kJ/mol. La variation d’enthalpie standard de vaporisation d’une mole d’eau peut être considérée constante dans les conditions envisagées et égale à ΔvapH0 = 40,6 kJ/mol. Sachant qu’à 2000 m d’altitude, la pression exercée par l’air est réduite à 0,763 atm, calculez
le temps de cuisson nécessaire pour un œuf dans l’eau bouillante à cette altitude.
J'ai trouvé qu'à cette pression là, la température valait 365 K, mais ensuite je ne vois pas quelle loi je pourrais utiliser pour calculer le nouveau temps de cuisson. Je m'imaginais pouvoir utiliser la loi d'Arrhénius pour calculer la constante cinétique, mais l'énergie d'activation n'est pas donnée dans l'énoncé.
D'avance merci pour votre aide!
-----