Bonjour,
Je n'arrive pas à traiter la deuxième partie de la 1ère question de l'exercice suivant:
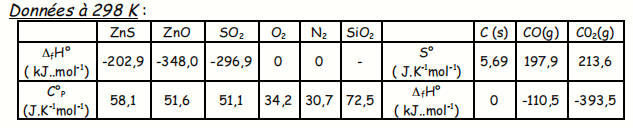
On étudie, à T = 1 300 K, la réaction de grillage de la blende :
ZnS (s) + 3/2 O2 = ZnO (s) + SO2 (g)
1. Calculer l'enthalpie standard de la réaction de grillage à T = 1 300 K.
On grille du sulfure de zinc pur. Calculer la température à laquelle serait
porté le mélange stœchiométrique {1 mole de ZnS + air} initialement à 298 K,
par suite de la chaleur dégagée par le grillage à 1 300 K de une mole de ZnS
(le système étant adiabatique). Cette réaction est-elle auto entretenue ? On
supposera que l'air contient 4 moles de diazote pour une mole de dioxygène.
J'ai trouvé ΔrH° =-449 kJ.mol-1
Ensuite, je ne vois pas comment faire.
Dans le corrigé, ils disent ça:
1× Δr H°+ (T2-T1)[ 1×C°p (ZnS) +1,5 ×C°p (O2) + 6×C°p(N2) ] +
(Tf-T2)×[ 1×C°p (ZnO) +1× C°p ( SO2)+ 6×C°p(N2) ] = 0
448700= (1300-298)×293,6+(Tf –1300) ×286,9
--> Donc Tf = 1838,5 K
Je ne comprends pas quel raisonnement permet d'aboutir à ce calcul.
Pourriez-vous m'éclairer ?
Merci d'avance.
-----



 (adiabatique isobare) puis H fonction d'état.
(adiabatique isobare) puis H fonction d'état.