Bonjour,
J'ai un problème en chimie organique pour savoir qui réagit avec qui sur des molécules complexes: je sais qu'on peut utiliser les pka pour chosiir et justifie rune réaction mais je ne comprends pas comment...
Par exemple: si on regarde la réaction d'un acide carboxylique avec un alcool:
- mécanisme correct: le doublet non liant de l'oxygène de l'alcool déprotone l'acide carboxilique et le O- ainsi formé sur l'acide carboxylique va chercher le carbone de l'alcool pour former un ester en éliminant de l'eau
- mécanisme qui me semble correcte et dont je n'arrive pas à comprendre le problème: j'aurais plutot formé un O- sur l'acide carboxylique par mésomérie avec le =O ce qui forme un C éléctrophile pour réagir avec un doublet de l'alcool... puis par prototropie j'arrive finalement à un ester
(cf photo)
Peut être qu'il n'y a rien à comprendre et qu'il faut juste apprendre ce mécanisme??
Merci de votre aide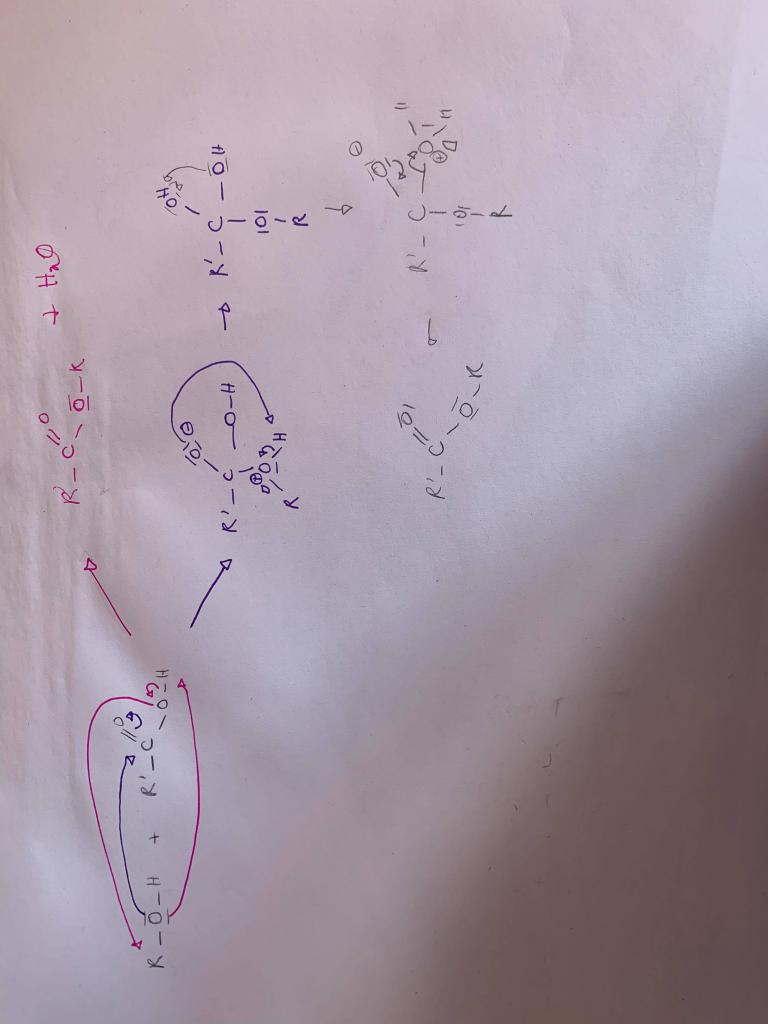
-----


