Bonjour,
Lorsque nous avons une pile électrochimique,
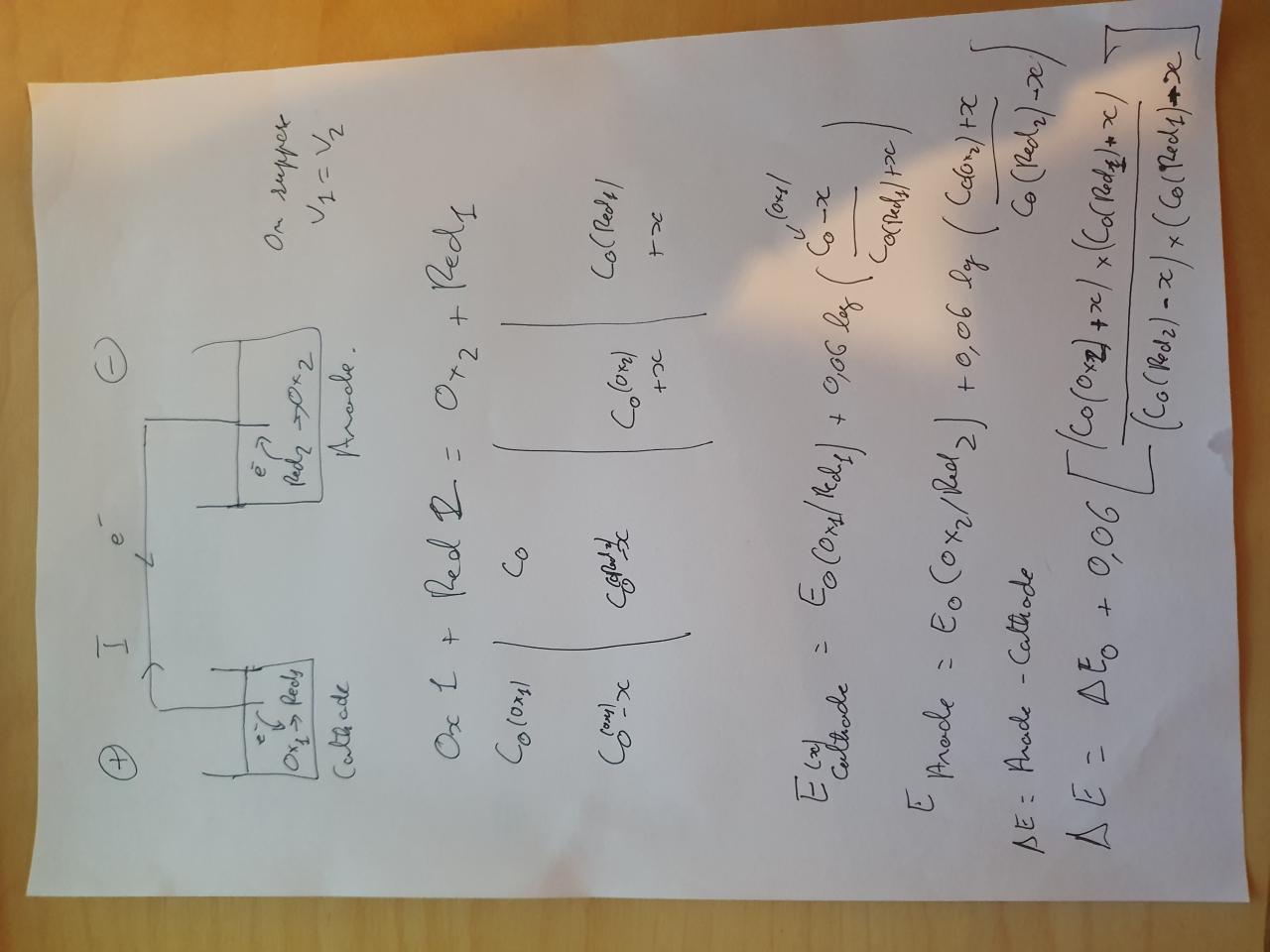
On sait d'après le potentiel de Nernst, que la ddp = Ecathode - Eanode
Et E cathode = E0 du couple + 0.06/n* log(ox couple/red couple)
et idem pour l'anode.
Je prends une pile ou les 2 demi piles sont des plaques de platines dans une solution redox (Fe3+/Fe2+ et ce que vous voulez pour l'autrepar exemple )
On voit bien qu'à mesure que la pile débite, les concentration vont évoluer, et donc les potentiels.
Cependant, je me pose la question, ce qui provoque l'arrêt d'une pile, c'est lorsque les Potentiels de chacun ont tellement évolué que les potentiels sont égaux ? Ou bien lorsqu'un des réactifs a été complètement consommé ?
(Je pose pas la question pour une demi pile métal-ion car ça parait peu probable quand on a une demi pile type ion-méal, car alors on a une concentration qui est "faible", prise en log, multipliée par 0,06... peu de chance d'avoir une influence sur le potentiel !)
Mais dans le cas de de piles redox ( donc ox et réd de chaue couple en solution), on a alors un rapport de concentration, et ça peut tout changer...
-----



 .
.