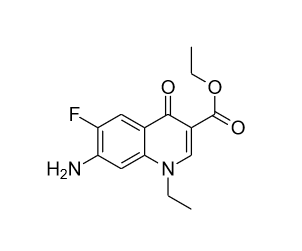
Bonjour,
Tout d'abord, merci pour le temps que vous consacrerez à me répondre.
J'ai réalisé des réductions d'un N3 en NH2 avec du zinc en milieu éthanol/eau dans le but d'avoir un réactif que j'utilise pour faire d'autres réactions. Le problème est que je n'arrive pas à me débarrasser du zinc lors de la récupération du produit amine car il n'est pas soluble dans l'eau. J'ai essayé de solubiliser le produit amine dans différents solvants pour pouvoir filtrer le zinc et récupérer mon produit mais il n'est soluble dans aucun solvant. Je ne sais pas trop quoi faire car j'ai essayé de réaliser la réaction que je souhaite faire à partir du produit amine mais elle n'a pas fonctionné; je pense que le zinc gène le bon déroulement de la réaction.
Auriez-vous une idée de ce que je peux faire pour me débarrasser du zinc s'il vous plaît.
Merci d'avance
-----