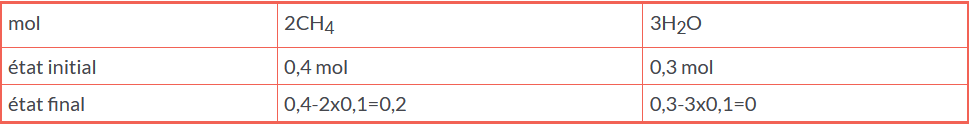
Bonjour, je sais comment remplir un tableau d'avancement mais je n'ai jamais compris le lien entre mol et coefficient stœchiométrique. Si on prend par exemple au hasard la réaction supposée totale suivante et que l'on s'intéresse qu'aux réactifs:
Si je ne me trompe pas, on peut dire qu'il y a au départ 2 moles de CH4 et je ne comprends pas le lien avec les 0,4 mol qu'on lui associe. Pareil pour l'eau. Ensuite, je ne comprends pas non plus le raisonnement pour le calcul des quantités de matière à l'état final. Je sais que vu que la réaction est totale, il y a forcément un réactif limitant dont sa quantité de matière finale va être nulle mais pourquoi tient-on compte du coefficient stœchiométrique dans le calcul final ? J'ai réussi jusque-là à quand-même pouvoir faire les calculs avec un tableau d'avancement car je connais le cours et les méthodes de base mais j'aimerais comprendre un peu mieux d'où ça sort et voir les liens. Quelqu'un saurait-il m'expliquer simplement les raisonnements ?
Merci d'avance à toute personne m'accordant un peu de son temps.
-----