bonjour,
ma question est je pense assez compliquée.
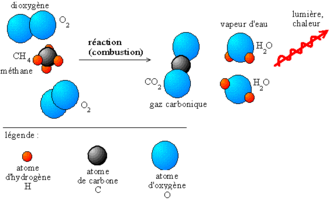
Je voudrais comprendre le phénomène d'incandescence. vous me pardonnerez j'espère mes approximations étant donné que je n'ai pas trouvé d'explication vraiment claires sur wikipedia.
Que se passe t'il vraiment au sein de la matière lorsque une bougie est allumée ? je suppose qu' une partie de la matière est "transformée" en énergie émise sous forme de photons, mais quelle partie de la matière est "transformée"( mais déjà n'est ce pas une erreur de penser que la matière est transformée en énergie??) ? Que se passe t'il vraiment dans un phénomène d'incandescence ?
merci par avance
-----