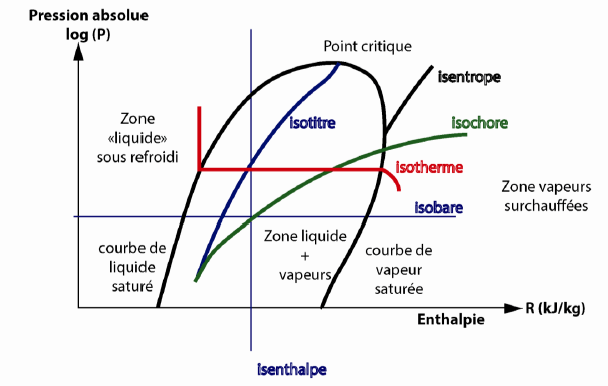
Bonjour,
Il y a quelque chose qui n'est pas clair pour moi lorsque je compare la formule delta_H = C delta_T à un diagramme enthalpique.
En effet delta_H = C delta_T pour une isobare implique que si la transformation est de plus isotherme, alors delta_H = 0.
Or sur le diagramme enthalpique on constate clairement que sur une isobare isotherme (sous la courbe de saturation) delta_H est non nul.
Quand peut-on alors vraiment utiliser cette formule ?
J'ai pensé qu'on ne l'utilise que lorsqu'il y a un changement de température, mais certains exercices utilisent la formule analogue pour l'énergie interne delta_U = C delta_T et le fait que la transformation est isotherme pour montrer que delta_U = 0. Y a-t-il alors des conditions différentes d'utilisation de delta_U = C delta_T et delta_H = C delta_T ? (D'autant plus que pour des phases condensées elles sont égales.)
Merci d'avance !
-----