bonjour a tous j'ai un petit probleme, voila je suis tombe sur un article le voici
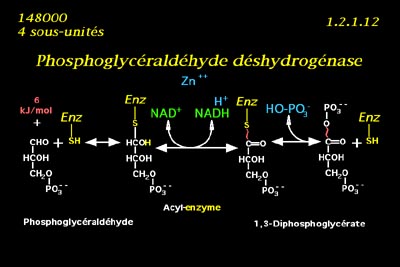
• La phosphoglycéraldéhyde déshydrogénase catalyse la première oxydation de la glycolyse cytoplasmique.
• Son substrat est le 3-phosphoglycéraldéhyde, et son coenzyme libre le NAD oxydé. Le mécanisme est de type bibi ordonné. Le complexe enzyme-substrat se forme grâce à une liaison covalente entre la fonction thiol d'une cystéine de l'enzyme et la fonction aldéhyde du substrat. On appelle acyl-enzymes les complexes enzyme-substrat liés par des liaisons covalentes. A cause de cette addition, l'état d'oxydation du carbone 1 du phosphoglycéraldéhyde est passé du niveau aldéhyde au niveau alcool secondaire, dont le potentiel d'oxydoréduction est plus élevé. Si pour voir clair nous imaginons l'hydrolyse de cette liaison nous verrons reparaître la fonction thiol et la fonction aldéhyde hydratée.
• Le complexe enzyme-substrat ainsi formé, réagit avec le NAD+ par une oxydoréduction couplée, où les hydrogènes du carbone 1 sont transférés sur le coenzyme, qui sera libéré réduit, avec un proton.
• Le produit est toujours lié à l'enzyme par une liaison covalente. Si nous imaginons à nouveau l'hydrolyse de cette liaison, nous libérons cette fois la fonction thiol et une fonction acide carboxylique : apparemment l'acyl-enzyme a été oxydé d'une fonction alcool secondaire à une fonction cétone, à un potentiel standard proche de celui du coenzyme NAD ; mais réellement le substrat 3-phosphoglycéraldéhyde a été oxydé en acide 3-phosphoglycérique à un potentiel d'oxydoréduction inférieur de plus de 200 mv à celui du coenzyme. L'hydrolyse libérerait donc plus de 30 kJ/mol : c'est une liaison riche en énergie.
• En fait le produit sera libéré par phosphorolyse, grâce à un ion phosphate. L'énergie interne de la liaison enzyme-produit est transférée sur une liaison anhydride d'acide mixte entre la fonction acide carboxylique et cet ion phosphate. Le produit final est donc le 1,3-diphosphoglycérate, molécule riche en énergie.
• L'énergie interne échangée entre substrat et coenzyme n'étant pas libérée en chaleur, cette réaction est presque isoénergétique et tout à fait réversible.
Voila donc mon probleme, c’est que moi je croyai si je me trempe pas qu’une reaction redox se deroule lorsque la differance de potentiel est positive c'est-à-dire ΔE =E accepteur – E donneur doit etre positive, comme c’est le NAD qui est l’accepteur et la phosphoglyceraldhyde le donneur, et comme le potentiel de ce dernier est plus eleve a cause de l’addition a l’enzyme,la on doit avoir une differance de potentiel negative
-----