Bonsoir, vous avez peut-être déjà vu cette question mais j'ai dû réouvrir une discussion nouvelle (au moins ce forum a une modération active, ça devient de plus en plus rare)
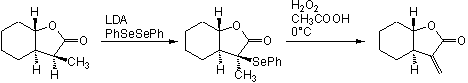
J'ai à la base cette molécule (http://img198.imageshack.us/img198/8...nstitre2hk.png). Dans la première étape, il y a une réaction avec KN(SiMe3)2 (4équivalents) puis par PhSeCl (10 équivalents). Dans la deuxième étape, il y aura réaction avec le mCPBA.
Donc je suppose que d'abord, il y aura une déprotection en alpha du carbonyle et que le carbanion réagira avec le PhSeCl. Mais alors pourquoi tant d'équivalents et vu l'étape suivante, je devrai avoir un alcène pour former un époxyde non ?
Je suis vraiment perdu à ce niveau, si vous pouviez m'éclairer un peu ce serait bien sympa.
Je récidive. Ouvrir une autre discussion SVP. Les images doivent être hébergées sur le site du forum.Pour la modération. Shaddock91
Ensuite j'ai une deuxième molécule (http://img402.imageshack.us/img402/8...nstitre2jp.png) qui réagit avec MeOCH2PPh3 et tBuOK. Jusque là, ça va c'est une simple Wittig. Mais ensuite, je dois faire réagir ça avec p-TsOH (catalyseur). Cette molécule devra réafir avec CH3PPh3 et NaN(SiMe3)2
Donc mon problème ici, c'est que je ne vois pas ce qui va se passer avec mon acide qui sert de catalyseur. En tout cas, je dois obtenir une cétone à un endroit vu que j'ai encore une Wittig qui va suivre :s
Merci d'avance pour un éventuel éclaircissement
-----