Bonjour,
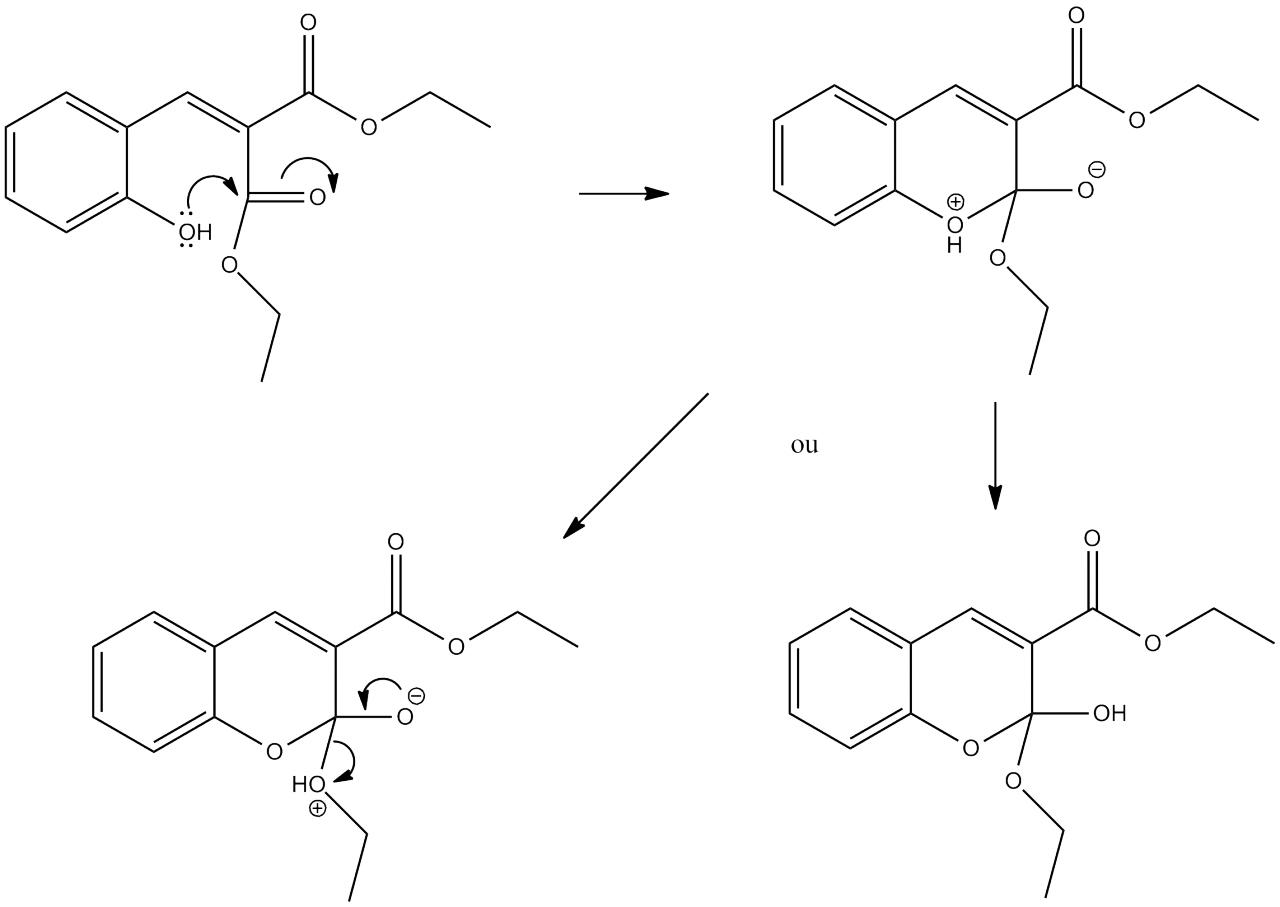
Je dois faire le mécanisme réactionnel de la formation de la 3-ethoxycarbonylcoumarine à partir du 2-hydroxybenzaldéhyde et du propan-1,3-dioate de diéthyle en présence d'une base faible, la pipéridine. Mon problème réside dans la cyclisation permettant d'obtenir le produit final.
Dans la première étape, la pipéridine va arracher un proton au niveau du CH2 central du propan-1,3-dioate de diéthyle. Le carbone voisin (qui était lié à l'hydrogène) est alors chargé négativement et devient un bon nucléophile. Il va attaquer le groupement carbonyle du 2-hydroxybenzaldéhyde, l'oxygène porte alors une charge -, il se reprotone en arrachant l'hydrogène de départ porté par la base. On refait le même mécanisme pour l'autre hydrogène (porté par le CH central du propan-1,3-dioate de diéthyle. Finalement, on forme une double liaison et on libère l'alcool (groupement OH) qu'on vient de former. Celui-ci va récupérer le H de la seconde étape (alors porté par la base) pour former de l'eau. (voir l'image en annexe indiquant la molécule que j'ai obtenu après les deux étapes ci-dessus)
On voit qu'il y a un effet mésomère mais je ne sais pas trop s'il est à l'origine de la cyclisation.
Merci de votre aide
-----





 merci, par contre il y a un petit problème, comment déprotoner l'alcool (car il faut l'alcoolate pour attaquer le carbonyl) ? La pipéridine (seule base du milieu) à un pKa de 11.22 (wiki) et l'alcool du cycle (de type phénol j'imagine) présente un pKa de 9,95. Du coup on est juste pour la déprotonation mais ca devrait passer (par contre si c'est le cas pourquoi l'alcool n'a pas été déprotoné en même temps que les H du CH2 (du propan-1,3-dioate de diéthyle ?).
merci, par contre il y a un petit problème, comment déprotoner l'alcool (car il faut l'alcoolate pour attaquer le carbonyl) ? La pipéridine (seule base du milieu) à un pKa de 11.22 (wiki) et l'alcool du cycle (de type phénol j'imagine) présente un pKa de 9,95. Du coup on est juste pour la déprotonation mais ca devrait passer (par contre si c'est le cas pourquoi l'alcool n'a pas été déprotoné en même temps que les H du CH2 (du propan-1,3-dioate de diéthyle ?).