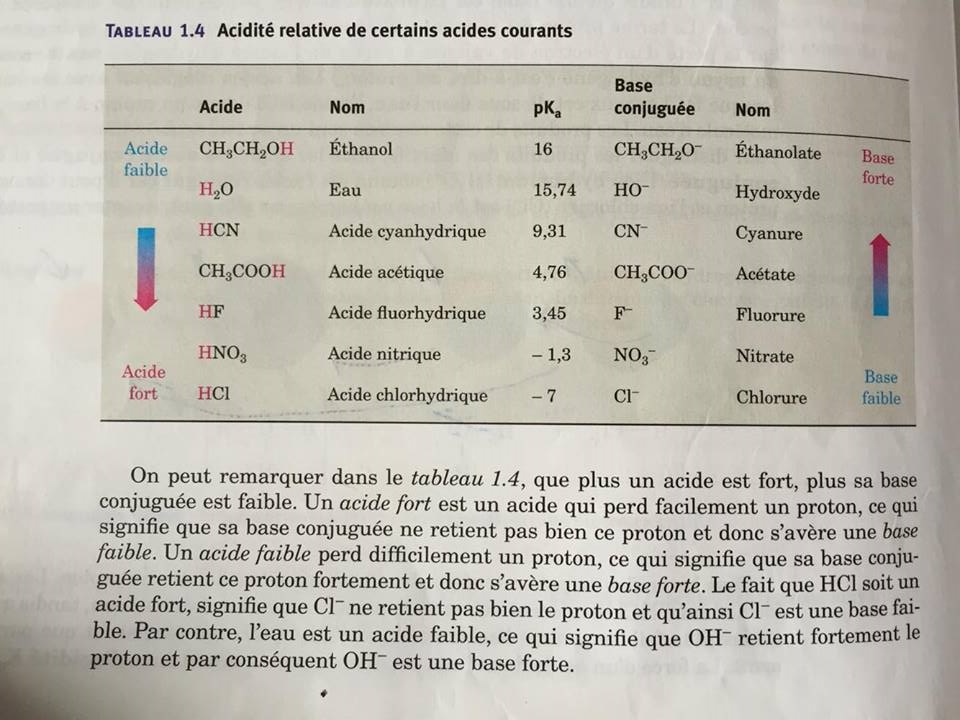
Bonjour,
Comme pka + pkb = 14
Je me demandais si un grand pka indique une base faible ?
la benzylamine par exemple, a un pka de 11.6 sur wikipédia. On indique les pka pour les acides normalement. Est-ce malgré tout une base ?
Un pKa négatif ou égal à 0 est une base forte. Mais à partir de combien est-il neutre (ni acide ni basique) et à partir de quel pka est-ce basique ?
Merci
Enfait les pKa ça me parle mais le pKb pas du tout, est-ce que quelqu'un saurait le pKb à partir de quoi c'est une base forte, une base faible, un acide faibe ?
Je sais ça fait beaucoup excusez moi..
-----