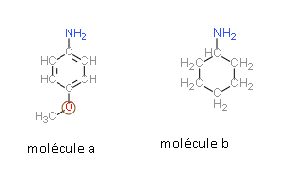
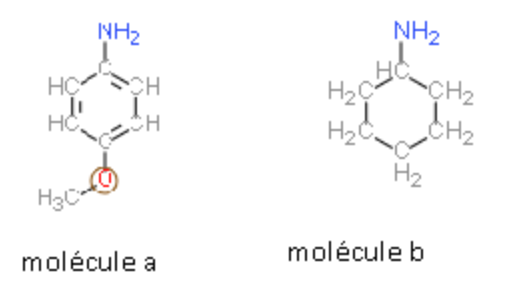
Bonjour, j'ai un problème pour classer ces deux molécules en fonction de leur acidité.
Pièce jointe 395675
D'après moi, la molécule (a) comporte un effet mesomère donneur (+M) du fait de l'oxygène et du cycle conjugué (et éventuellement un effet (-I) car présence du O), et la molécule (b) comporte seulement un cycle non conjugué, donc un effet inductif donneur (+I).
L'effet mésomère étant considéré + fort que l'effet inductif, j'en déduis que la molécule (a) est + stable en tant qu'acide, donc un acide + faible.
Or, la correction qui m'est donnée pour cette exercice m'indique que la molécule (b) est + acide que la (a).
donc voila mes questions : Ou est l'erreur dans mon raisonnement ?
Faut-il compter l'effet inductif attracteur de l'oxygène dans la molécule (a), et pourquoi ?
Je vous remercie de votre attention.
-----