Bonsoir , quelqu'un peut me diriger pour la dernière question svp.
énoncé :
L’acide orthophosphorique de formule H3P O4 est un triacide
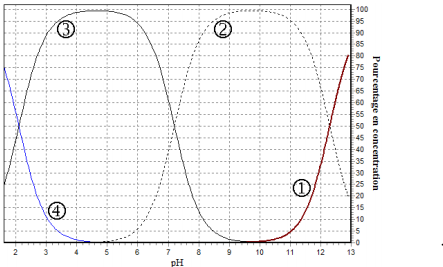
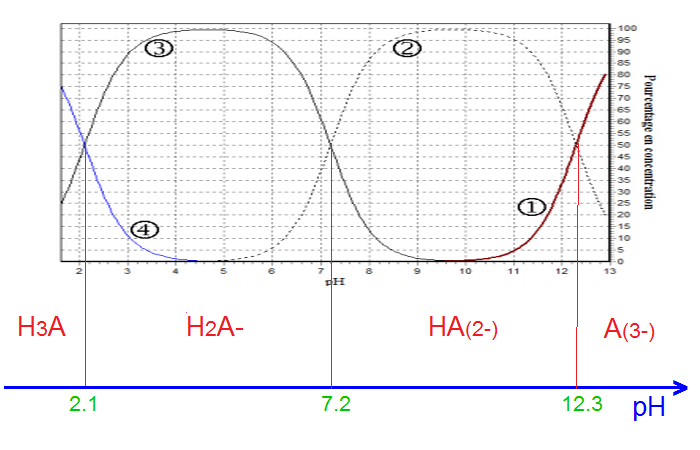
noté H3A. Le document ci-contre
donne son diagramme de distribution en fonction du pH. Les
courbes tracées représentent le
pourcentage de chacune des espèces contenant lorsque le pH varie.
1) Identifier chacune des courbes.
2) En déduire les constantes pKai
et Kai relatives aux trois couples
mis en jeu.
3) Déterminer les domaines de pH
pour lesquels :H3PO4 (supérieur ou = 90%) ; b) H2PO4-−(supérieur ou = 90%)
4) Quelle est la composition d’un mélange obtenu par addition d’un volume V0 = 10, 0 mL d’une
solution commerciale d’acide orthophosphorique dans de l’eau distillée de manière à obtenir un
volume V = 2 L de solution lorsque le pH du mélange à la valeur pH = 3, 0 ? La solution
commerciale d’acide phosphorique a une densité d = 1, 71 et contient P = 80% en masse d’acide
orthophosphorique.
Données : µ(H2O) = 1, 0 g.mL−1
; M(H3P O4) = 98, 0 g.mol−1
Réponses :
1) courbe 1 : PO42-
2: HPO42-
3:H2PO42-
4: H3PO4
2) pour le couple (H3A/H2A-) : pka1 = 2,1 , Ka1 = 7,9 .10^-3
de la même manière pour les 2 autres couples
3)H3PO4 (supérieur ou = 90%)h est entre 0-1
; b) H2PO4−(supérieur ou = 90%) : ph est entre 3 -6
4) pour la composition : j'en ai aucune idée
( j'extrapole la valeur de pH = 3 sur le graphe et je trouve : [H3PO4 ]=11% ( à peu prés )
et [H2PO4-]: 89%
il faut trouver les valeurs des différentes concentrations mais j'ai pas su comment les déterminer
merciiiii d'avance , bonne soirée.
-----




 et remonter ainsi à HPO42-.
et remonter ainsi à HPO42-.