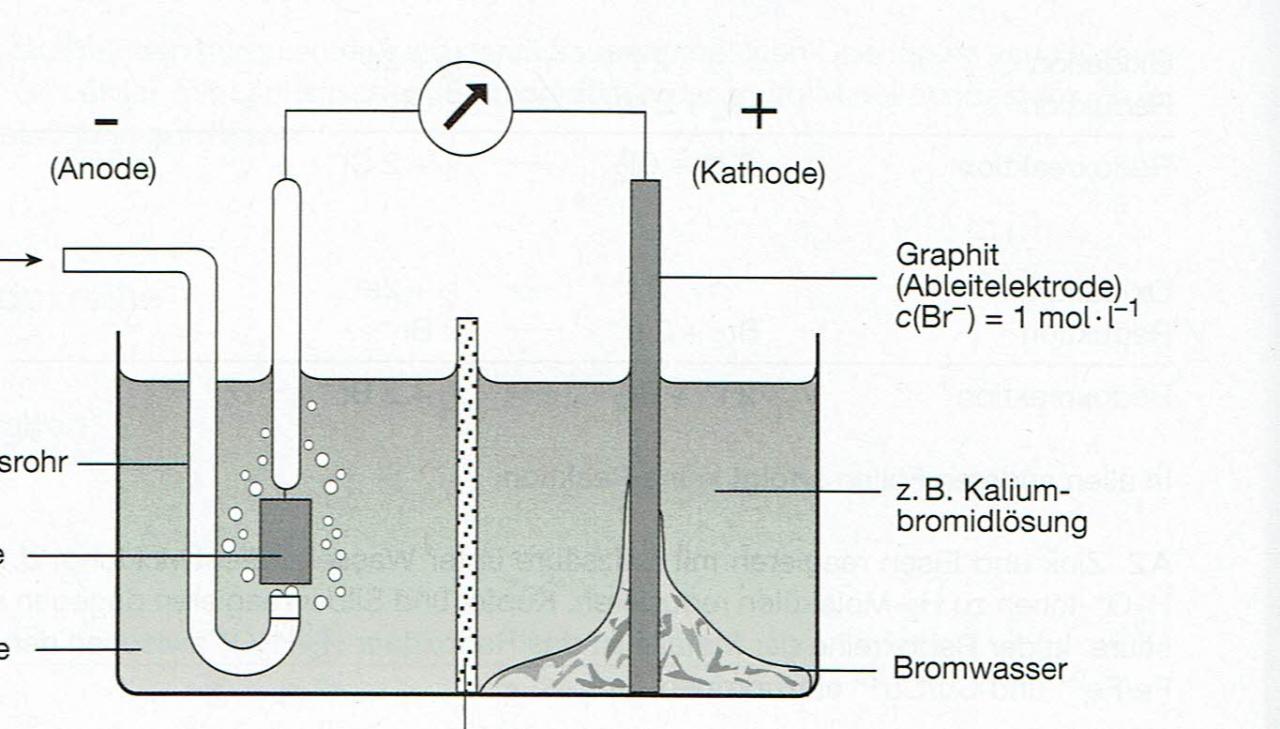
Bonjour, j'ai trouve le schéma suivant dans un bouquin (allemand).
Pièce jointe 445508
Y est représenté une cellule galvanique:
demi-élément de gauche: l'électrode à hydrogène.
demi-élément de droite: électrode en carbone plongée dans une solution de bromure de potassium.
E0 de 2 Br-/Br2 = + 1,07 V, l'électrode à hydrogène est donc bien l'anode (H2 --> 2 H+), et l'électrode der carbone est bien la cathode.
Mais sur le schéma, on représente la formation d'eau bromée... et je ne comprends pas.
Si l'électrode en graphite est bien la cathode (comme c'est d'ailleurs indiqué sur le schéma), alors il y a réduction et la réaction Br2 --> 2 Br- devrait s'y dérouler.
Il s'agit d'un très bon bouquin, et c'est pour cela que j'hésite. Pouvez-vous me confirmer l'exactitude de mon raisonnement ou, le cas échéant, m'expliquer où je commets une erreur?
Comment représentiez vous cette cellule? Je pensais à ceci: Pt/H+, H2 //Br2,Br-/C
Merci d'avance !!
-----