Bonjour
J'attaque un nouveau TP et j'aurai besoin un peu d'aide
Étude d’un indicateur coloré : le bleu de bromothymol
À la fin du 18ème siècle, on commence à utiliser les indicateurs colorés naturels dans les procédés industriels à des fins de
contrôles. On constate alors que les solutions acides n’ont pas toutes le même effet sur les couleurs des indicateurs ; cela
conduit à la mise au point des premières échelles de comparaison des forces des acides. Il faudra attendre encore un
siècle pour développer les premières synthèses d’indicateurs.
Actuellement les indicateurs colorés sont utilisés pour estimer les valeurs de pH de solutions, par exemple dans le cas des
analyses d’eau de piscine. On se propose ici de caractériser l’un de ces indicateurs : le bleu de bromothymol (BBT) en
déterminant son pKa et ainsi de voir si le BBT peut être ou non adapté à l’analyse d’une eau de piscine sachant que le pH
idéal pour les eaux de piscine doit être compris entre 7,2 et 7,4.
Solution Si Vi pHi Ai (630 nm) [In2-] [InH-]
S1 4 4,7 0 0 0,0000273
S2 4,5 4,5 0 0 0,0000273
S3 5 5,6 0,03 0 0,0000273
S4 5,5 6,4 0,113 0 0,0000273
S5 6 6,7 0,264 0 0,0000273
S6 6,5 6,9 0,422 0 0,0000273
S7 7 7,0 0,595 0 0,0000273
S8 7,5 7,3 0,719 0 0,0000273
S9 8 7,6 0,81 0 0,0000273
S10 8,5 7,7 0,82 0 0,0000273
S11 9 8 0,834 0 0,0000273
S12 9,5 0,867 0 0,0000273
J'espère que le pH relevé est cohérent par contre je n'ai pas eu le temps de faire pour 9,5 si je mets 8,1 pensez-vous que cette donnée soit à peu près correcte?
1.Pourquoi les différentes solutions Si obtenues n’ont –elles pas la même couleur ?
Parce que le B.B.T existe sous deux formes :
- Sa forme acide de teinte jaune que l’on note IndH-.
- Sa forme basique de teinte bleue que l’on note Ind2-.
2. D’après le diagramme de prédominance étudié en classe de 1ère, quelle est la grandeur limite à partir de laquelle
il y a un changement d’espèce prédominante.
La grandeur limite est quand pH=pKA [acide]=[base]
3. Donner alors une estimation de cette grandeur en observant les différentes solutions obtenues.
On sait que pKA = 7,1 de la solution S1 à S6 la teinte est jaune vert nous sommes dans une forme acide et de la solution S7 à S12 couleur vert bleu forme basique.
Je ne sais pas si je réponds clairement à la question.
Changement à S7 avec un pH à 7,0
4. Pour déterminer cette grandeur plus précisément, il faut pouvoir déterminer les concentrations de IndH- et de
Ind2- dans chacune des solutions.
Quelle technique d’analyse pourrait nous permettre d’étudier ces différentes solutions et déterminer ainsi les
concentrations des espèces qu’elles contiennent ?
On pourrait mesurer l'absorbance de la solution (Si) à l’aide d’un spectrophotomètre
5. Calculer la concentration totale en BBT (qui sera notée C0) dans chacune des solutions Si.
C = [IndH-] + [Ind2-] = =C.BBT×V BBT / V TOTALE
C =3,0 x 10-4 x 0,002/0,020
C= 3x 105-
Pourriez-vous me dire jusqu'à là si je n'ai pas trop d'erreur.
En vous remerciant par avance.
-----



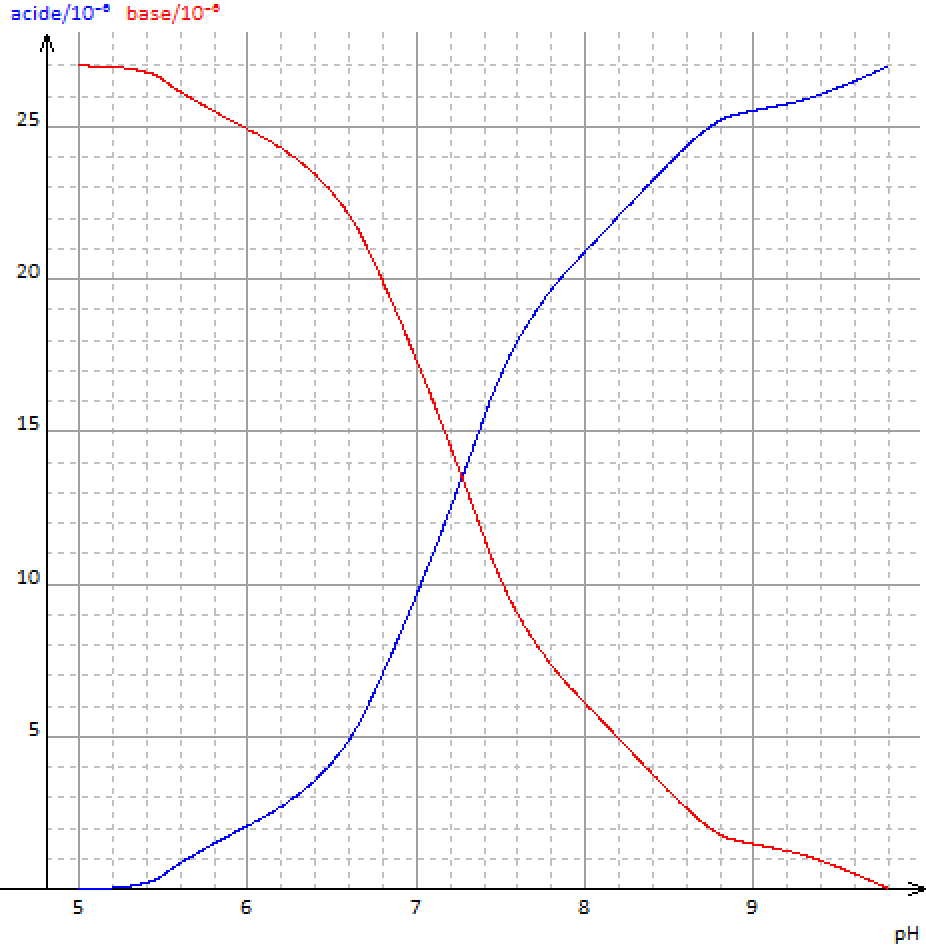
 et au max quand tout le BBT est sous forme acide, donc (acide)=c=2,7 10-5, A=Amax
et au max quand tout le BBT est sous forme acide, donc (acide)=c=2,7 10-5, A=Amax