Bonjour, j’ai un exercice à faire et je n’y arrive vraiment pas. Est ce que vous pourriez m’aider s’il vous plaît.
On mélange 100 mL de nitrite de sodium (NaNO2) à 6,0 10^-2 mol.L-' avec 100 mL de
chlorure d'ammonium NH4Cl à 2,0 10^-2 mol.L-1
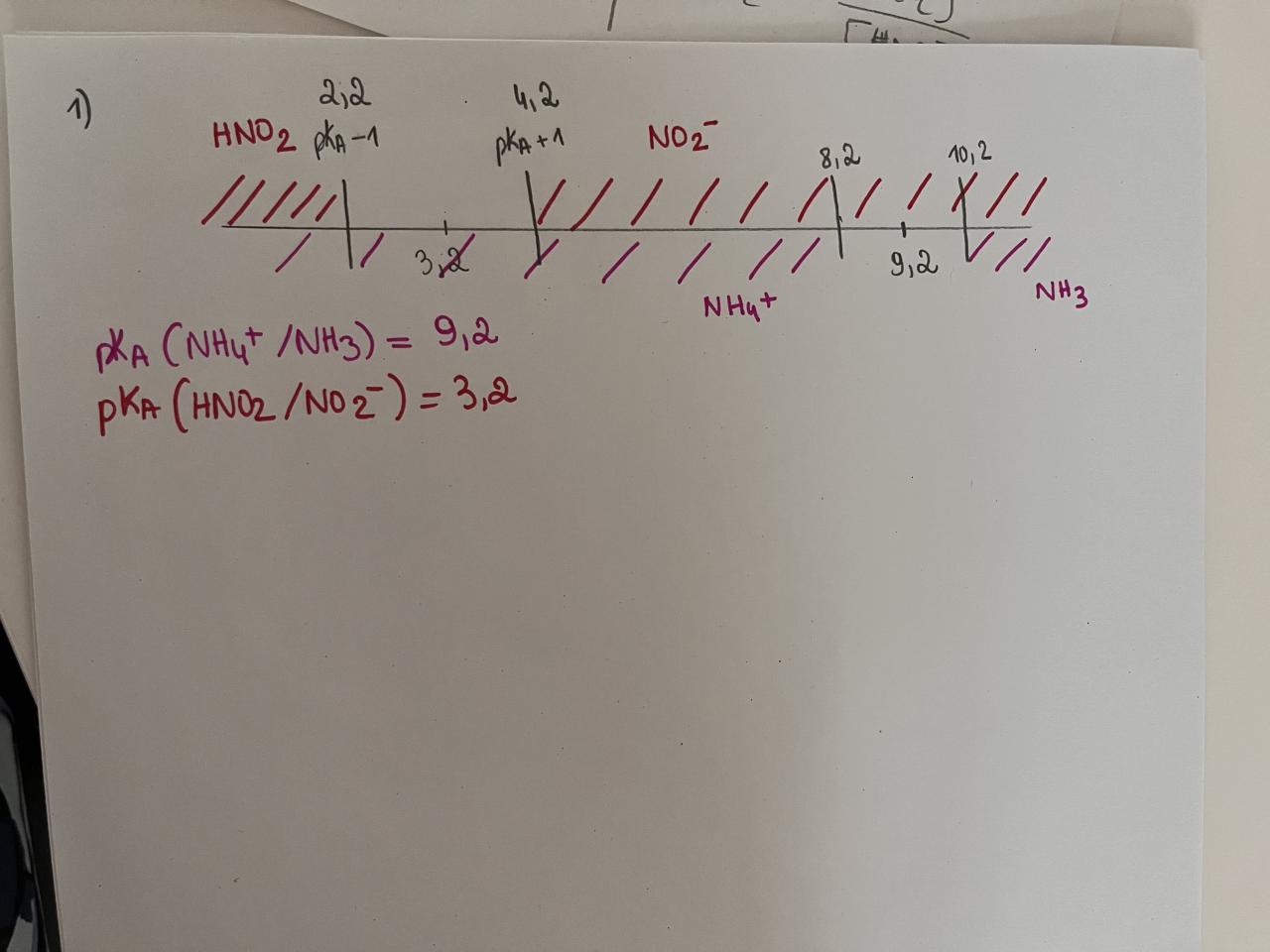
1) Donner le diagramme de prédominance des espèces en fonction du pH.
2) Ecrire les réactions acido-basiques possibles en solution.
3) Calculer le pH du mélange à l'équilibre. Préciser et vérifier les hypothèses utilisées.
Données à 25 °C: pKA (NH4^+ / NH3) = 9,2
pKA (HNO2/NO2^-) = 3,2
Je suis sensée trouver un pH qui est égal à 6,45
Je vous remercie d’avance!
-----