Oui je suis d'accord on peut sans doute leur trouver un sens.
Ma définition ne semble pas en contradiction avec celle de wiki. Mais imaginer qu'on peut sommer deux fonctions ne correspondant pas au même ensemble statistique (i.e. pour F avec deux systèmes à des températures differentes par exemple) c'est réellement sommer des patates et des carottes selon moi.Bon, je ne prétends pas que wikipédia soit la référence absolue. Mais on retrouve quand même souvent cette définition là. Pour moi les quantités extensives sont l'équivalent physique de la notion mathématique de mesure. D'ailleurs à ce propos, je classe également des choses comme la quantité de mouvement (même si le terme est inhabituel dans ce contexte) comme une quantité (vectorielle) extensive, au contraire de la vitesse.
Une façon de le voir est que, en définitive, à N,V et T fixés, on peut construire un espace probabiliste (X(N,V),µ(T)) où X(N,V) est l'ensemble des états microscopiques possibles avec ces contraintes extensives N et V et µ(T) la mesure de proba associée paramétrée par la température T (la seule variable intensive de l'ensemble statistique considéré).
Il se trouve que l'energie libre est proportionnelle au logarithme de la fonctionnelle génératrice des moments de la distribution associée à µ(T). On ne peut donc pas mélanger impunément, il me semble, des energies libres à températures differentes.
Je n'ai jamais dit qu'il recquerait quoique ce soit, j'ai juste dit que, trivialement (il faut que je fasse le calcul ais pas cette nuit), le bon potentiel thermo devait pouvoir être trouvé si on a un gaz parfait.Je ne vois pas en quoi mon exemple requiert que les gaz soient parfaits, ni même en quoi utiliser des liquides fausserait l'exemple (sous l'hypothèse bien sur que les 4 sous systèmes soient homogènes et que des variations d'altitudes ne soit pas considérées comme pertinentes).
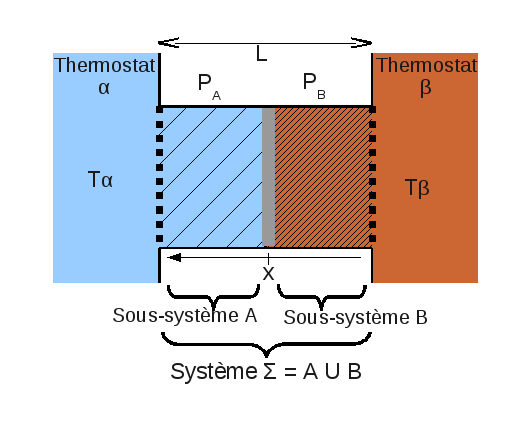
Je ne crois pas m'intéresser à un seul état d'équilibre ici. Pour être un peu plus clair dans mon propos, pour un gaz parfait, l'energie interne est seulement fonction de la température et du nombre de particules. Comme tu es dans un ensemble statistique à deux thermostats, par définition, l'energie interne du gaz en A ne changera jamais tout au long de la relaxation et idem pour le gaz en B. Le volume total de ces deux systèmes et le nombre de particules à l'intérieur étant également constant, tout se passe exactement comme si le système {A+B} était isolé.Désolé Gatsu mais j'ai l'impression que c'est exactement avec ce genre d'affirmation que j'ai mis des années à comprendre la thermodynamique... Le système a la possibilité d'échanger de la chaleur donc il ne peut PAS être question de S ici (le fait qu'à l'équilibre il n'échange pas n'y change rien). Un potentiel ça sert à être minimiser/maximiser, nous sommes d'accord ? Considérer des histoire de minimisation en s'intéressant à un état d'équilibre seul comme tu sembles le faire n'a AUCUN SENS. Le mot même de minimisation (d'une fonction f) intervient lorsqu'on prend en compte un ENSEMBLE de valeurs d'entrée potentielles x et qu'on considère la valeur de f(x). C'est d'ailleurs ce que tu disais toi même dans un précédent post. Sur un seul point ça ne veut rien dire que f atteint son minimum (ou ça veut dire qqch de trivialement vrai : elle y atteint également son maximum, sa moyenne, sa médiane, son deuxième centile ...). Nous somme bien d'accord là dessus ?
Je n'ai pas dit que le système était rigoureusement isolé mais étant donné que si tu mesures régulièrement les propriétés de ton système {A+B} (dans le cas du gaz parfait), tu ne verras pas de difference avec un système isolé, alors il n'y a pas de raison pour que les prescriptions qui s'appliquent à un système isolé ne s'applique pas à {A+B}.Si je m'interesse à un état d'équilibre de mon système (que ce soit celui avant déverouillage des parois ou aprés) je dois considèrer l'ensemble des états qu'y peuvent m'y amener. Et si l'on se met d'accord pour ne considérer (parce que c'est l'énoncé qui le dit) que les états où le volume global est le même que celui d'arrivé, où la quantité de matière est preservée, où les températures de chaque composante thermique sont les mêmes que celles d'arrivé (qu'il y en ait une, deux ou trente mille) grâce à l'utilisation de thermostats (et donc qu'il y a à tout moment la POSSIBILITE d'échanger de l'energie thermique), c'est bien F et non S qui est minimisé. Et ce n'est certainement parce qu'à l'arrivé l'energie est fixe que S acquiert de l'importance. Un système isolé c'est un système qui NE PEUT PAS échanger de la matière ou de l'energie à cause des contraintes extérieures, pas un système qui ne le fait pas lorsqu'il est dans un état particulier.
Il est clair que l'on ne réfléchit pas pareil mais peut ne vois tu pas la difficulté (peut être uniquement apparente) que je trouve à trouver un potentiel thermodynamique général dans ton exemple.Je ne vois pas trop où est le problème avec ça. Mais j'ai l'impression qu'on ne réfléchit pas avec le même espace en tête. Mon système a pour espace d'état une variété différentielle à 8 dimensions. Son energie totale a pour différentielle
Les contraintes internes et externes m'impose de ne considèrer qu'un sous espace de dimension 1 (je perds 4 dimensions parce les températures des quatres sous systèmes sont figées par les thermostats, et 3 autres dimensions parce que les volumes dépendent tous de la position x de mes parois).
Je vois pas en quoi ça gène de faire sur U autant de transformée de Legendre (directionnelle puisque c'est toujours le cas en thermo) que voulu.
Le problème principale pour trouver une telle fonction est que tu dois pour écrire la chaleur reçue par l'exterieur échangée avec {A+B}, qui est l'intégrale d'une 1-forme du genre :
Toute l'ingéniosité des potentiels thermodynamiques est de prouver que
où f est une 0-forme fonction uniquement des observables du système {A+B} i.e. une fonction d'état du système pour utiliser le jargon thermodynamique et oùest un coefficient de proportionnalité.
Pour cela on utilise usuellement le premier principe de la thermo mais dans le cas ci dessus cette dernière equation n'est pas suffisante il me semble...
-----






 ) :
) :
 .
. mais alors c'est quoi ton système ?
mais alors c'est quoi ton système ? ?
?