Bonjour,
J'ai un exercice sur une installation pour faire des glaces à 0°C.
Comment puis-je calculer Wréversible ici? Quelles formules dois-je utiliser?
Merci d'avance
-----

Bonjour,
J'ai un exercice sur une installation pour faire des glaces à 0°C.
Comment puis-je calculer Wréversible ici? Quelles formules dois-je utiliser?
Merci d'avance

Toujours la même remarque : ce ne sont pas des formules mais des principes, raisonnement ...
Il faut d'abord calculer l'énergie nécessaire pour fabriquer la glace,
puis traduire réversible par un cycle frigo idéal avec "la source gratuite à 20°C" et calculer le travail de ce cycle.
Pb : je ne trouve pas 27,41 kJ/kg !

En passant par la variation d'exergie cela donne le résultat du corrigé (qui devrait être le même avec Carnot mais j'ai peut-être fait une erreur quelque part)

En utilisant le principe de Carnot pour le refroidissement et la congélation de 1 kg, l'on retrouve bien les 27,41kJ.
Attention pour la partie refroidissement de 20°C à 0°C, il faut effectuer une intégrale puisque le rapport énergie/chaleur dépend de la température.
Comprendre c'est être capable de faire.

J'ai refait le calcul avec Carnot, çà marche !

Bonjour,
quel est le principe à utiliser pour calculer l'énergie qu'il faut pour fabriquer la glace? Merci encore

Il suffit de suivre le cheminement : passage de l'eau liquide de 20°C à 0°C puis passage de l'eau liquide à 20°C à solide à 0°C.
Mais comme l'exo se réfère à l'exergie, autant l'utiliser directement en utilisant la propriété fondamentale de celle-ci.

C'est cette définition?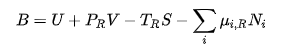

Oui, mais on peut simplifier : comme PR=100 kPa=P0 (celui de la définition des tables)
On peut d'autre par oublier le terme "chimique"
Pour obtenir

Pourquoi peut-on oublier le terme chimique svp?
Pouvez-vous donner plus de précisions sur la simplification du terme pr
Comment puis-je faire pour calculer le terme trs ?
U c’est donc l’énergie interne du système ?

D'abord une rectification ; j'ai fait une faute de frappe : B=H-TRS
Parce qu'il n'y a pas de réaction chimique et donc ce terme est constant.
C'est le milieu ambiant, cela doit se trouver dans le premier paragraphe de votre cours.
Qu'appelez-vous trs ?
Il y a parfois des variations de notation en physique, mais j'ai toujours vu l'énergie interne notée U.

Le PR de la définition de l'exergie est la pression ambiante 1 bar.
H=U+PV et les tables donnant en particulier l'enthalpie de fusion sont calculées pour P0=1bar.
Donc le H utilisé dans l'exercice est H=U+P0V=U+PRV

J'ai compris pour trs : TRS
Le résultat du calcul vous est fourni à la dernière ligne de l'énoncé pour le liquide et pour le changement de phase, je suppose que vous connaissez le lien entre enthalpie de fusion et entropie de fusion.

Nous avons toutes les formules à utiliser ici à savoir H= Cp Delta T= 4,187 kJ/kgK*(273-293) car la température finale est 0°C? initial est de 20°C?
Le résultat vous est fourni, vous parlez de 333,40 kJ/kg
Je dois donc utiliser delta s liq= Cp*ln(Tfin/Tin)?
Pour passer de solide à liquide, je dois apporter de l'energie, l'enthalpie de la glace va donc augmenter. De l'autre côté, l'entropie va augmenter vu qu'on augmente le désordre . Est-ce le lien dont vous parlez? Parce que sinon delta g= H-TS, l'energie libre de Gibbs

C'est bien cela.
C'est plutôt le dernier (mais on peut le faire avec premier et deuxième principe appliqués directement à la fusion) : on a un équilibre de phasesoit


Est-ce que la température finale est bien 0°C? initial 20°C? Est-ce correct de dire que vu qu'ici c'est un rapport ce n'est pas grave de laisser ça en degré et non Kelvin?


J'ai donc 4.187*ln (273.15/293.15)=-0.2958

-0.296 est donc égale delta S liq= delta rH/T
Ici T= 273.15
Du coup -0.296*273.15= delta r H= -80.162kJ

Vous mélangez les deux \Delta S : celui du liquide qui passe de 20°C à 0°C et celui du passage liquide->solide.

Est-ce que c'est juste delta S liq= 4,187*ln(273.15/293.15)?
=-0.296?

Oui c'est bien cela, il faut maintenant calculer \Delta s (fusion)

Pour calculer delta S fusion je dois utiliser la même formule ? C'est-à-dire Cp*ln(...)?
Ou alors celle-ci?
Merci encore

On me donne donc la chaleur latente de la glace à 0°C= 333.40 kJ/kg
A partir de là on doit diviser par température de fusion 273.15K
Ce qui donne 1.22 kJ ?

C'est bien cela

Que dois-je faire de cette valeur parce que si je l'additionne avec la précédente -0.296, j'ai 0.9247

Il ne faut pas oublier que vous avez calculé pour la fusion et que la transformation est une solidification.

Il faut donc ajouter à ce calcul la solidification? Merci

Vous avez fait le calcul pour la fusion (solide -> liquide), or lors de la fabrication de glace ce qui se produit est la solidification (liquide -> solide), donc ?

Comment puis-je calculer la solidification? Je dois calculer l'enthalpie de solidification ou prendre directement ça en ligne? Parce que je l'ai trouvé en ligne et c'est "Enthalpie de solidification : 330 kJ.kg-1.K-1 aux conditions TPN (T=273,15 K, P=101325 Pa)"
Une fois que je l'ai, dois-je la rajouter aux autres?

