Par directement, mais cela est applicable aux liquides.
C'est le cas.
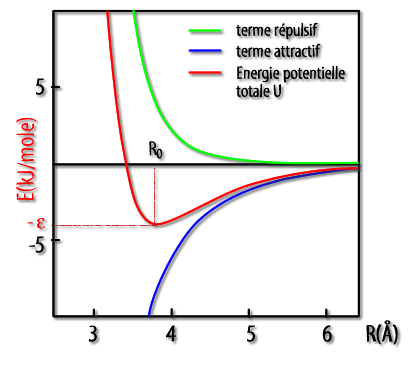
Justement, il se fait que l'intensité de la répulsion et l'intensité de l'attraction varient différemment avec la distance. De ce fait, il existe un intervalle de distance où l'on peut avoir attraction entre atomes autorisant la transition d'un état gazeux à l'état liquide*, mais interdisant l'état solide (répulsion lorsque les atomes essaient de trop se rapprocher pour former un solide).
*Sous certaines conditions de températures et de pressions et dépendant de la nature des atomes en jeux.
L'image dans le lien ci-joint illustre comment ces deux effets se somment:
https://uel.unisciel.fr/chimie/struc...ch09_2_01.html
-----