Bonjour à tous,
(petit nouveau sur ce forum que j'apprecie)
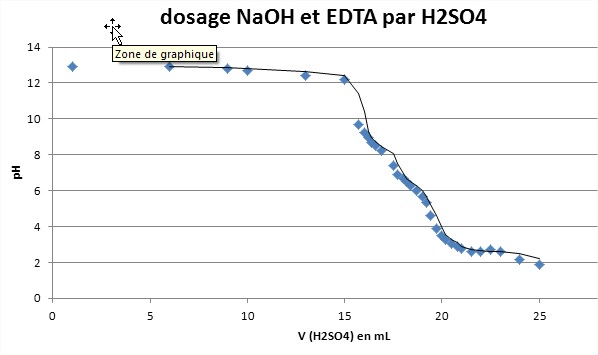
je suis salarié dans une entreprise d'electronique à lyon, j'aimerais savoir si il est possible de doser par volumétrie une solution X contenant de la soude, de l'EDTA et un mélange de tensioactifs par un acide type acide sulfurique (ou chlorhydrique).
cette solution X est utilsée pour graver et nettoyer du silicium. Le but serait de contrôler la teneur en soude uniquement pour maitriser le process...
J'aimerais aussi savoir le rôle de l'EDTA exactement dans ce genre de solution?
merci d'avance !
Marc
-----