Bonjour, je n'arrive pas à faire seul cet exercice.
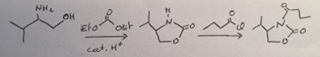
Ayant passé en revu toutes mes formules bilan sur ce chapitre je ne vois pas du tout quels mécanismes sont à l'origine de ces deux premières étapes.
Merci d'avance pour votre aide
-----

Bonjour, je n'arrive pas à faire seul cet exercice.
Ayant passé en revu toutes mes formules bilan sur ce chapitre je ne vois pas du tout quels mécanismes sont à l'origine de ces deux premières étapes.
Merci d'avance pour votre aide


J'avais pensé à une trans-estérification pour le premier mécanisme

J'ai essayé mais ça ne donne pas le bon produit..

Oui c'est à peu près ça. Le carbonate d'éthyle peut subir 2 additions nucléophiles qui produisent l'élimination de 2 molécules d'éthanol. Cela conserve la fonction C=O. D'abord, l'amine qui est plus nucléophile que l'alcool attaque le carbonyle. Ensuite, même si un alcool n'est pas très nucléophile, le fait que la deuxième addition soit intramoléculaire fait que la réaction se fait mieux.
Pour la deuxième étape, il s'agit d'une bête addition/élimination encore. Un chlorure d'acide est très électrophile et le chlorure est un bon groupe partant. La réaction se fait sans mal. Il n'y a que l'azote pour réagir à ce stade.

D'abord merci. Je n'arrive pas à former le cycle, l'alcool nucléophile réagit sur quelle partie électrophile ?
A chaque fois c'est Et-O qui est éliminé ?

J'ai cependant réussi à faire la deuxième étape !
Juste la première qui me gêne, il faut commencer par protonner un Et-O ?

Je pense que c est ce mechanisme la. Et tu fais la mime chose avec l alcool après.

J'ai le droit d'utiliser encore un H+ pour faire partir l'éthanol ?

Non c'est de la prototropie il me semble !

Bonsoir,
Qu'entends-tu par "utiliser encore un H+" ?

Je me suis corrigé c'est bon
Pourquoi dans le modèle de kimist le NH2 devient NH ??

IMG_3045.jpg
Voici ce que j'ai fait

Ça m'a l'air juste.

Oui pardon, j ai fais ça vite fais au boulot parce que je m ennuyai. Oui ça me semble juste aussi !

Du coup, je n'ai jamais utilisé le catalyseur H+ ...

En réalité, l’éthanol est protoné par le catalyseur et non l amide ou l alcool.

Bonsoir
Ce catalyseur te sert à activer le carbonyle du carbonate (tu le sais sans doute, les acides catalysent les réactions d'estérification).
Du fait que l'attaque ultérieure de l'amine soit intramoléculaire, ça se fait bien (sinon, amine et ester éthylique ne réagissent pas trop bien ensemble).
Cordialement

