Bonsoir tout le monde
J'ai décidé de créer cette discussion car j'ai quelques questions qui, malgré mes recherches, restent sans réponses
Je travaille sur un projet dans le cadre de mes études, une batterie aluminium air. Nous avons réussi à en construire une qui, sans vouloir me vanter, fonctionne plutôt bien. À un détail près cependant : nous n'arrivons pas à régénérer l'électrolyte.
En effet, nous utilisons une forte concentration de potasse (1.5 mol/L) de sorte à ce que la réaction d'oxydation d'Aluminium (donc à l'anode) soit :
Al + 4OH- = Al(OH)4- + 3e-
Cette réaction est avantageuse pour nous puisque le produit de la réaction Al(OH)4- est soluble de l'eau, et ne précipite donc pas sur l'électrode en aluminium (ce qui aurait pour conséquence d'empêcher la batterie de fonctionner).
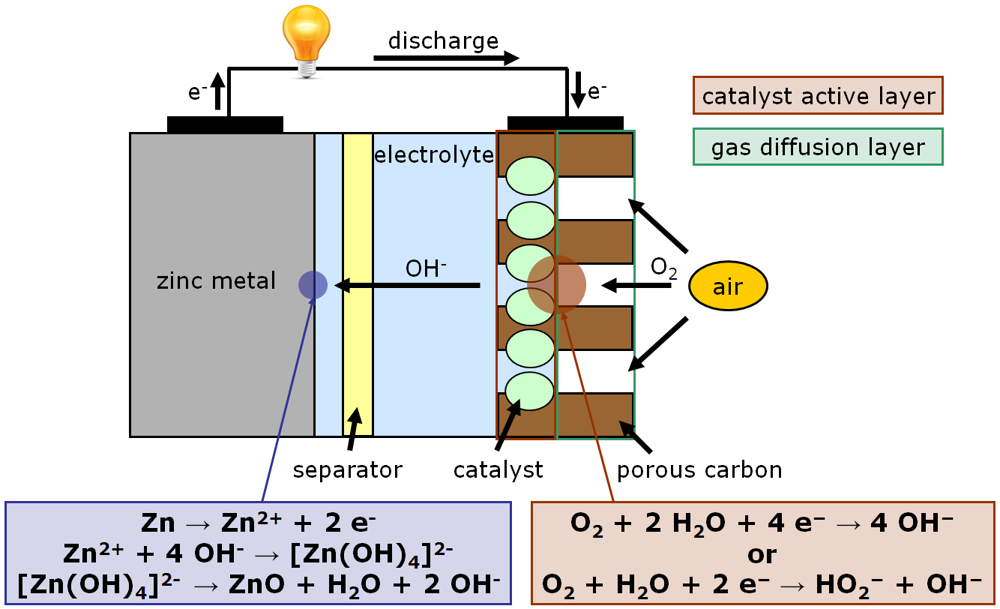
Maintenant du côté de la cathode, nous avons :
O2 + 2H2O + 4e- = 4OH-
Ainsi la réaction totale de la batterie est :
4Al + 4OH- + 3O2 + 6H2O = 4Al(OH)4-
On remarque cependant qu'il y consommation d'ions OH- et en effet, sur le prototype réalisé on s'aperçoit que le pH chute durant l'expérience.
J'ai tenté de me renseigner et certains prétendent qu'il serait possible de procéder à cette réaction :
Al(OH)4- = Al(OH)3 + OH-
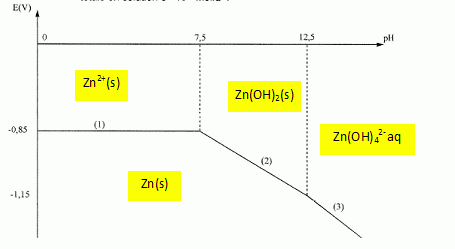
Cela permettrait ainsi de renouveler les ions OH- consommer, cependant je ne vois pas du tout comment "déclencher" cette réaction, de façon à précipiter Al(OH)3 loin des anodes en aluminium. D'après le diagramme potentiel-pH de l'aluminium, je serait tenté de dire en faisant circulé l'électrolyte et en baissant le pH dans un compartiment séparé, mais cela équivaudrait à détruire les ions OH-, or l'on souhaite justement pouvoir les réutiliser. Je me suis renseigné sur le procédé Bayer et certains prétendent qu'il suffirait d'injecter des "amorces" de Al(OH)3, afin d'en faire précipiter d'avantage mais je ne vois vraiment pas comment cela est possible.
J'ai aussi pu constater qu'il semble y avoir la même chose sur les batterie Zinc Air.
Je n'arrive pas à comprendre comment l'on parvient à redécomposer l'ion [Zn(OH)4]2-, de façon à régénérer les ions OH-
Bref, quelqu'un serait il me renseigner ?
Bonne soirée à tous
Quentin
-----