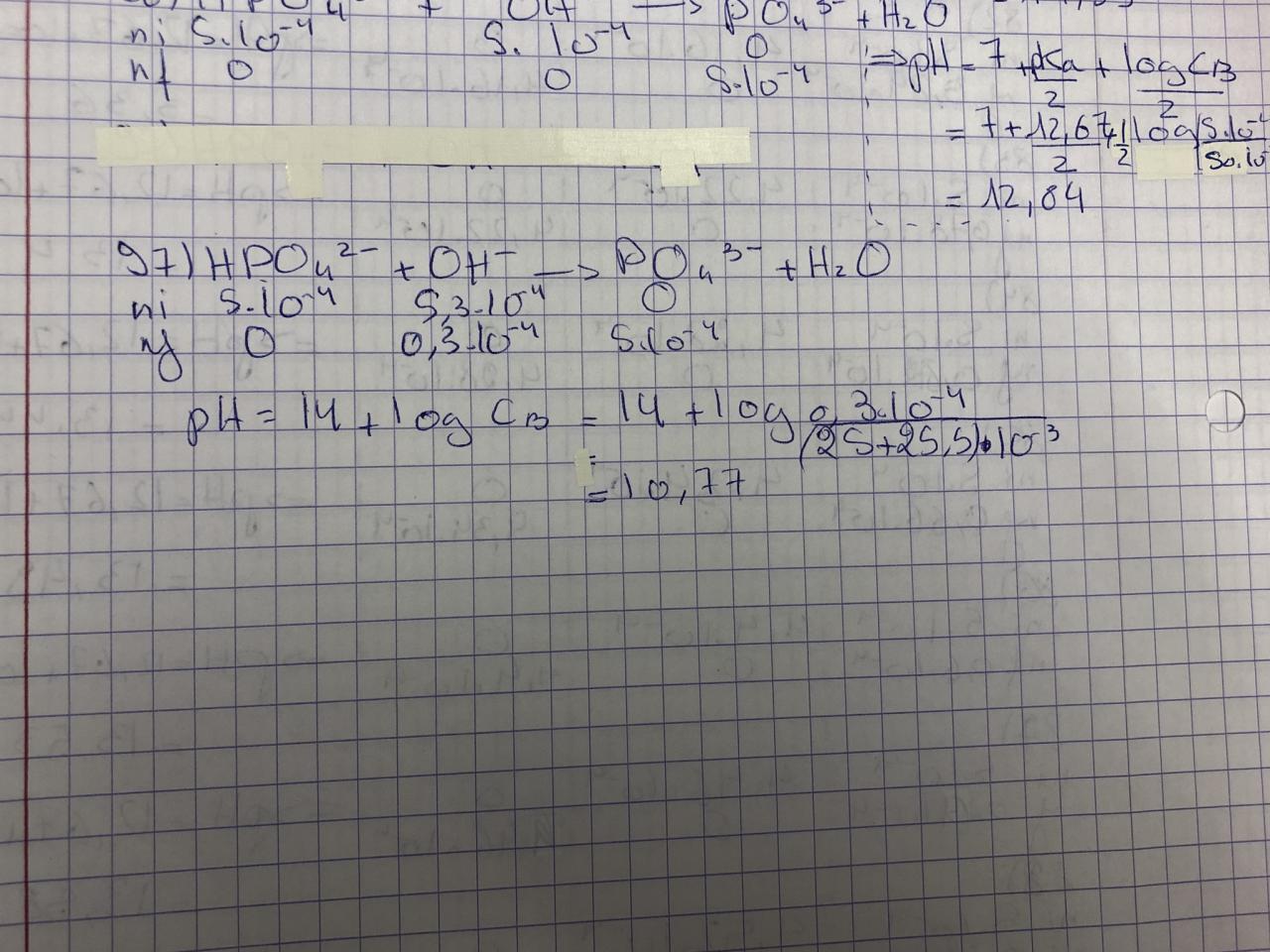Bonjour!
Nous avons fait fait de la pH-métrite en labo et j’ai un peu de mal dans mes calculs de pH. On titre 25ml de H3PO4 (0,02M) par 24,7 ml de NaOH (0,06M). Lorsque le H3PO4 a été consommé ainsi que le (H2PO4)-, il me reste : (HPO4)2- + OH- —> (PO4)3- +OH-
J’utilise la formule de mélange tampon cependant je dépasse pH=14, ce qui n’est pas normal
Je fais : pH=12,67+log[(14,76-10)/0,24)]=14,1
Je fais -10 pour les moles de H3PO4 et (H2PO4)- qui on été consommé. Pouvez-vous m’aider à comprendre mon erreur svp?
-----